 |
|
|
 |
DIEGO A. FABILA, LUIS F. DE J. HERNÁNDEZ, SERGIO DE LA ROSA, J. MANUEL DE LA ROSA Y SUREN STOLIK ISAKINA
|
|
LA LUZ. UNA HERRAMIENTA EN EL DIAGNÓSTICO DEL CÁNCER |
|
 |
Una de las principales causas de muerte a nivel mundial es el cáncer, cuya reducción de mortalidad se ha logrado a través de su detección temprana y la oportuna aplicación de tratamiento
|
|
La Organización Mundial de la Salud (OMS) estimó que —con 7.6 millones de casos— la principal causa de muerte en el mundo durante el año 2008 fue el cáncer (principalmente de pulmón, estómago, hígado, colon y mama), lo cual equivale a 13% de todas las muertes a nivel mundial. Alrededor de 70% de estas muertes por cáncer ocurrieron en países de bajos y medianos ingresos. Además, se prevé que la mortalidad debida al cáncer en el mundo seguirá aumentando, y llegará a más de 13.1 millones de casos en 2030.
En México, el cáncer constituye un importante problema de salud pública, al ser la segunda causa de mortalidad, después de las enfermedades cardiovasculares.1
Sin lugar a duda, el diagnóstico y tratamiento temprano del cáncer es un punto fundamental para minimizar los índices de morbilidad y mortalidad. En la actualidad, el diagnóstico del cáncer se realiza en la mayoría de la ocasiones mediante la toma de una biopsia, prueba que es considerada como el estándar de oro. Sin embargo, este procedimiento tiene diversas limitaciones, por ejemplo: es sumamente invasivo, el tiempo de diagnóstico es largo, pues una vez obtenida la muestra, se requiere un estudio de laboratorio que puede demorar varios días en arrojar un resultado y, en ocasiones, éste puede ser erróneo, especialmente cuando el tamaño de la muestra es pequeño. Por otro lado, la toma de una biopsia es un proceso que en, algunos casos, puede producir dolor y sangrado en los pacientes. Todo esto ha conducido a la búsqueda de otras técnicas, tales como las imágenes de resonancia magnética, la tomografía computarizada, los rayos X y el ultrasonido, entre otras; lamentablemente, también con posibilidades de no obtener los diagnósticos correctos y, en ciertos casos, resulta imposible distinguir las fases tempranas de la patología.
En los últimos años se ha buscado técnicas que puedan superar y/o complementar las limitaciones de los métodos mencionados. Una de las áreas en la cual se ha realizado un gran número de investigaciones, durante los últimos 20 años, es la espectroscopia óptica in situ; en particular, la espectroscopia de fluorescencia y la espectroscopia de reflexión óptica difusa.
El principio básico de estas técnicas consiste en hacer incidir luz sobre un tejido pues, el esparcimiento y la reemisión de dicha luz están fuertemente influidos por la composición y estructura celular del tejido; en tal sentido, tendrán un comportamiento particular para un tejido normal. La progresión de una enfermedad o cáncer causa un cambio en la composición y la estructura celular de los tejidos afectados, produciendo un cambio en el comportamiento del esparcimiento y reemisión de la luz, respecto al de un tejido normal.
Son estos cambios en el esparcimiento y en la reemisión de luz los que se estudia, para así poder realizar una diferenciación entre el tejido sano y el anormal. Este principio es conocido como biopsia óptica y ha sido estudiado en diversos órganos del cuerpo humano, como lo son: cérvix, piel, cerebro, seno, colon, riñón, entre otros.2
En comparación con los métodos tradicionales para la detección de cáncer, las técnicas basadas en espectroscopia óptica se caracterizan por ser rápidas, mínimamente invasivas, y permitir la realización de un diagnóstico in situ y en tiempo real; puesto que los cambios en las propiedades de la luz emergente del tejido son muy sensibles a los cambios bioquímicos y morfológicos asociados con el cáncer —por ejemplo: los tumores de cerebro producen cambios en el metabolismo energético celular; aún más, el crecimiento del tumor conduce a la heterogeneidad del flujo sanguíneo, debido a la muerte celular—. En casos como éste, los niveles de intensidad de la radiación ultravioleta y visible de auscultación no representan un peligro para la salud, incluso, si son aplicados durante un tiempo de exposición relativamente largo.
Por otro lado, los avances tecnológicos, principalmente en las fuentes y detectores de luz (LED y fotodiodos), posibilitan el desarrollo de equipos de tamaño y consumo eléctrico reducido. Gracias a ello se han podido construir analizadores de radiación miniatura (los cuales caben en la palma de la mano), basados en arreglos lineales de detectores diminutos que permiten capturar todo el espectro de radiación visible (tal como se observan los colores del arco iris por el ojo humano), así como la radiación ultravioleta (la cual no es visible para el ojo humano) en forma instantánea.
Estos dispositivos, en conjunto con el desarrollo de las fibras ópticas —las cuales permiten transportar la luz hacia y desde cualquier punto de interés—, han hecho posible la construcción de equipos totalmente portátiles, los cuales permiten realizar observaciones y mediciones tanto in vivo como in situ, de cualquier tejido del cuerpo humano.
Con lo anterior, se ha hecho factible incorporar la espectroscopia óptica en los sistemas comerciales de endoscopia, laparoscopia, bronquioscopia, colonoscopia, etc., para llegar a órganos internos del cuerpo humano.
|
 |
| Si bien la evaluación de una biopsia es útil para diagnosticar y determinar un tratamiento, hallazgos recientes basados en la interacción de la luz con el tejido ofrecen tal servicio sin remoción de tejido y en menor tiempo |
|
EL ESPARCIMIENTO DE LUZ Y LA FLUORESCENCIA |
Cuando la luz interacciona con un tejido, en la superficie de éste se puede producir reflexión y absorción. Si el tejido es semitransparente, la luz comenzará a interactuar con las diferentes moléculas que lo conforman, y ésta presentará múltiples desviaciones, que darán la impresión de turbidez en el medio y quedará sujeta, además, a la absorción de ciertos colores,** que componen la luz incidente (figura 1). Un ejemplo del esparcimiento de luz se aprecia cuando se ilumina la mano con luz de un apuntador láser (figura 2); aquí se aprecia que la luz se difunde en la mano, una parte de ella la cruza y otra vuelve a salir de ésta por el lado donde se hizo incidir, a esto último se llama reflexión óptica difusa. Las partículas que absorben la luz (denominadas cromóforos) pueden tener propiedades fluorescentes (esto es, posteriormente a la absorción de luz, reemiten luz de un color diferente al que absorbieron; normalmente de una longitud de onda mayor a la absorbida, por ejemplo, cuando la luz ultravioleta no visible que se usa en las discos incide sobre nuestras ropas, de éstas se desprende luz visible muy llamativa, como se muestra en la figura 3. La fluorescencia permite obtener información acerca del tipo de molécula presente en el tejido, mientras que la reflexión óptica difusa nos da información acerca de la localización de las moléculas dispersoras, esto es, de la estructura del tejido. Ambos fenómenos perfectamente diferenciados para tejido normal y tejido anormal.3,4
 |
| En la ESIME, Zacatenco-IPN, se han realizado estudios de detección de tejido anormal con base en los fenómenos de esparcimiento y fluorescencia, mediante fuentes de luz ultravioleta y visible, con resultados alentadores |
|
ESPARCIMIENTO Y FLUORESCENCIA EN TEJIDO NORMAL Y TEJIDO ANORMAL |
En el Laboratorio de Biofótonica, de la ESIME Zacatenco-IPN, se trabaja en la detección de tejido anormal con base en los fenómenos de esparcimiento y fluorescencia, producidos con fuentes de luz ultravioleta y visible; esto a través de la toma de imágenes y del análisis de la luz antes y después de la interacción con el tejido. Para la toma de imágenes se han desarrollado lámparas de ultravioleta basadas en leds y se ha hecho uso de cámaras fotográficas digitales de alta sensibilidad (ISO 6000). Se ha desarrollado, además, sistemas que permiten medir tanto la fluorescencia como la reflexión óptica difusa de tejido biológico.
El equipo se caracteriza por ser de tamaño pequeño, totalmente portátil y de fácil uso. Consiste básicamente en un analizador de luz (espectrómetro), una fibra óptica, una computadora portátil y un led de luz ultravioleta (figura 4). El procedimiento de medición es muy sencillo: por medio de la fibra óptica, la luz ultravioleta del led es dirigida hacia el tejido para iluminarlo y, al mismo tiempo que se ilumina el tejido, se captura la luz reemitida por éste (fluorescencia y reflexión óptica difusa) para ser llevada a nuestro espectrómetro, el cual, a su vez, envía la información a la computadora, donde finalmente, se genera un gráfico que indica la intensidad de cada uno de los colores integrantes de la luz reemitida por el tejido (este gráfico es conocido como espectro). Es importante resaltar que las mediciones se realizan en un tiempo no mayor de 10 segundos.
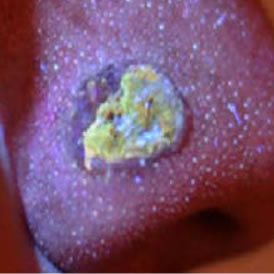
Con el equipo, se han realizado pruebas en diferentes tejidos como piel,5 cerebro6 e hígado,7, 8 y hemos logrado resultados alentadores, pues observamos claras diferencias en los espectros obtenidos. En la figura 5 se muestra una imagen de la fluorescencia y el respectivo espectro de un cáncer basocelular (CBC). En la figura 6A y 6B se muestra los espectros de reflexión óptica difusa y de fluorescencia obtenidos durante intervenciones quirúrgicas realizadas en el Instituto Nacional de Neurología y Neurocirugía (INNN) de la Ciudad de México, así como en el Hospital Civil de Guadalajara.
El objetivo principal de las cirugías fue extraer la mayor cantidad del tumor conocido como Glioblastoma Multiforme (GBM, que es el cáncer más agresivo de cerebro), en pacientes afectados. Como se puede apreciar en los gráficos, las diferencias son bastante claras, pues las intensidades de reflexión difusa y de fluorescencia en ambos casos son totalmente diferentes para el tejido cerebral sano y el afectado por el tumor.
En la Unidad de Medicina Experimental de la UNAM, del Hospital General de México, se han realizado pruebas en tejido hepático, con el objetivo de buscar diferencias en los espectros de tejido hepático sano y con fibrosis.
La fibrosis hepática es el paso decisivo hacia el desarrollo de cirrosis, una grave enfermedad incapacitante cuyo índice de mortalidad es muy elevado en todo el mundo. Por tanto, la detección oportuna de fibrosis es una de las estrategias más promisorias para el control de esta terrible enfermedad humana. Los resultados más importantes se presentan en las figuras 6C y 6D, donde se puede apreciar claramente las diferencias en la intensidad de reflexión difusa y de fluorescencia, tanto de tejido hepático sano como del afectado por fibrosis.
La importancia de estos resultados radica en el hecho de que a partir de ellos se han generado algoritmos computacionales que, de forma automática, son capaces de clasificar un espectro dado entre tejido sano o tejido con algún tipo de patología, por lo que puede considerarse una herramienta auxiliar de diagnóstico para el médico. Hasta el momento se han obtenido porcentajes de sensibilidad y especificidad superiores a 80%; sin embargo, se continúa trabajando para mejorar los resultados obtenidos hasta el momento.
1. World Health Organization (2013). http://www.who.int/mediacentre/factsheets/fs297/en/
2. Q. Liu (2011). “Role of Optical Spectroscopy Using Endogenous Contrasts in Clinical Cancer Diagnosis”. World Journal of Clinical Oncology, 2(1), pp. 50.63.
3. J. Welch, J. C. Martin y Van Gemert (1995). Optical-Thermal Response of Laser-Irradiated Tissue, 2.a ed., Springer.
4. Tuan Vo-Dinh (2003). Biomedical Photonics Handbook, 2.a ed.
5. D. A. Fabila, J. M. de la Rosa, S. Stolik, et al. “Portable System for Measuring Fluorescence Signals of Biological Tissue”. IEEE Latin America Transactions, 9(7), (2011): pp. 1012.1017.
6. J. de la Rosa, D. A. Fabila, L. F. Hernandez, et al. “In Vivo Spectroscopy for Detection and Treatment of GBM with NPt@ Implantation” in Nanomedicine and Cancer Therapies-Recent Advances in Nanoscience and Nanotechnology Volume 2, Apple Academic Press, Chapter 2, (2012): pp. 37.48.
7. D. A. Fabila, J. M. de la Rosa, S. Stolik, et al. “In Vivo Assessment of Liver Fibrosis Using Diffuse Reflectance and Fluorescence Spectroscopy a Proof of Concept”. Photodiagnosis and Photodynamic Therapy 9, (2012): pp. 76.82.
8. D. A. Fabila, L. F. Hernández, J. de la Rosa, et al, “Optical Spectroscopy for Differentiation of liver tissue under different conditions of disease: an ex vivo study”. 8th Ibero American Optics Meeting/11th Latin American Meeting on Optics, Lasers, and Applications, Proc. of SPIE. Porto, Portugal, Jul, 2013.
◂ World Health Organization (2013). http://www.who.int/mediacentre/factsheets/fs297/en/
◂ Q. Liu. “Role of optical spectroscopy using endogenous contrasts in clinical cancer diagnosis”. World Journal of Clinical Oncology, 2(1), (2011): pp. 50.63.
◂ J. Welch and Martin J. C. Van Gemert, Optial-Thermal Response of Laser-Irradiated Tissue, 2nd Ediion, Springer, 1995.
◂ Tuan Vo-Dinh, Biomedical Photonics Handbook, 2nd Edition, 2003.
|
|
|
Diego Adrián Fabila Bustos es Ingeniero en Biónica por la UPIITA-IPN y Maestro en Ciencias en Ingeniería Electrónica por la ESIME-IPN. Actualmente, es estudiante del Doctorado en Comunicaciones y Electrónica de la ESIME-IPN.
Luis Felipe de Jesús Hernández Quintanar es Ingeniero en Biónica por la UPIITA-IPN y Maestro en Ciencias en Ingeniería Electrónica por la ESIME-IPN. Actualmente, es estudiante del doctorado en Comunicaciones y Electrónica, en de la ESIME-IPN.
Sergio de la Rosa Gutiérrez es médico pasante en Servicio Social, en la ESM-l IPN.
José Manuel de la Rosa Vázquez es Doctor en Ingeniería, por la Universidad Técnica de Berlín. Pertenece al Sistema Nacional de Investigadores (I). Actualmente, es investigador en el Programa de Maestría en Ciencias en Ingeniería Electrónica de la ESIME-IPN.
Suren Stolik Isakina es Doctor en Tecnlogía Avanzada por CICATA-IPN. Pertenece al Sistema Nacional de Investigadores (I). Actualmente, es investigador del Programa de Maestría en Ciencias en Ingeniería Electrónica de la ESIME-IPN.
|
|
|
|
